利用成果(プレスリリース)
アロステリック薬剤はタンパク質の構造平衡を変化させる
-既存のGPCR標的薬の限界を克服する新薬開発に期待-
理化学研究所(理研)生命機能科学研究センター生体分子動的構造研究チームの嶋田一夫チームリーダー(次世代天然物化学技術研究組合技術顧問)、今井駿輔上級研究員、金子舜研修生らの共同研究チーム※は、Gタンパク質共役型受容体(GPCR)を標的とする既存の医薬品の薬効が、新たなGPCR標的薬として期待されているアロステリックモジュレーター(アロステリック薬剤)により高められる仕組みを明らかにしました。
本研究成果は、GPCRを標的としたアロステリック薬剤の合理的な設計や、既存品より高い薬効度を持つ医薬品の開発に貢献すると期待できます。
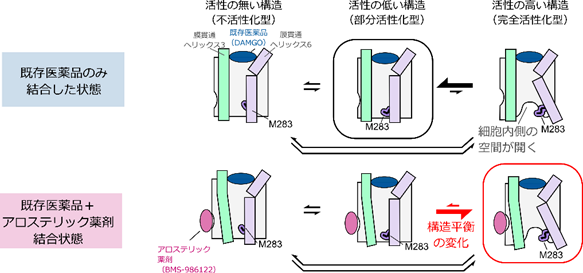
膜タンパク質であるGPCRを標的とする医薬品は、GPCRの細胞外側に存在するポケットに結合してGPCRを活性化します。しかし、既存薬はGPCRの活性を十分に引き出すことができないことから、このポケット以外の場所に結合して作用するアロステリック薬剤の実用化が期待されています。
今回、共同研究チームは、溶液核磁気共鳴(NMR)法を用いた立体構造解析により、GPCRの一種μオピオイド受容体(MOR)に対するアロステリック薬剤の活性化機構を調べました。その結果、MORは活性のない不活性化型、活性の低い部分活性化型、活性の最も高い完全活性化型の三つの構造を行き来する平衡状態(構造平衡)にあり、各構造の存在比がMORの活性を決定していることが分かりました。既存薬が単独で結合しても完全活性化型構造の存在比は低い一方、アロステリック薬剤が同時に結合すると完全活性化型構造の存在比が増加し、MORの活性もさらに上昇することが明らかになりました。 本研究は、科学雑誌『Proceedings of the National Academy of Sciences of the United States of America(PNAS)』オンライン版(4月11日付:日本時間4月12日)に掲載されます。
Kaneko, S.; Imai, S.; Asao, N.; Kofuku, Y.; Ueda, T.; Shimada, I. Activation Mechanism of the μ-Opioid Receptor by an Allosteric Modulator. Proc. Natl. Acad. Sci. 2022, 119 (16). https://doi.org/10.1073/pnas.2121918119.
詳細は理化学研究所ホームページ
アロステリック薬剤はタンパク質の構造平衡を変化させる | 理化学研究所 (riken.jp)


